In Grimms Märchen »Das singende springende Löwenäckerchen« liefert sich die Tochter eines Händlers freiwillig einem Löwen aus, um ihren Vater vor dem Biest zu retten. Sie gibt dafür ihre Freiheit auf. Das Motiv des uneigennützigen Verzichts wiederholt sich seitdem in zahllosen Erzählungen – in den kommenden Monaten dürfte es für Tausende Menschen ganz real werden.
Auch sie müssen sich womöglich die Frage stellen, ob sie selbst auf etwas Wertvolles verzichten wollen. Und anders als die Tochter im Märchen würden sie damit nicht unmittelbar einen ihnen nahestehenden Angehörigen schützen. Sie müssten sich für etwas deutlich Abstrakteres hergeben: das größere Wohl.
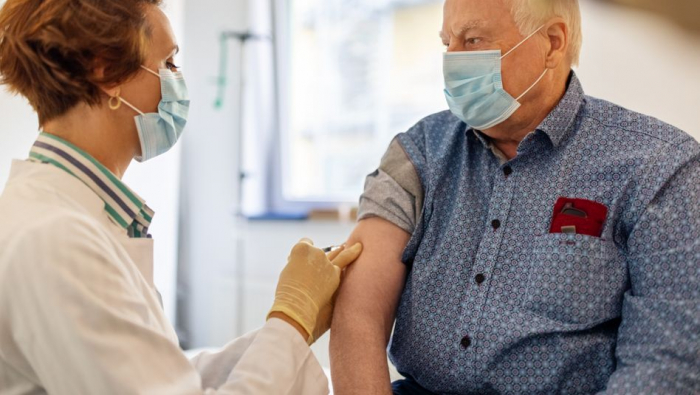
Drei Hersteller von Impfstoffkandidaten gegen das Coronavirus haben innerhalb der vergangenen Wochen vielversprechende Daten veröffentlicht, nach denen die Impfstoffe bis zu 95 Prozent wirksam sein könnten. Bewertungsverfahren in Europa laufen bereits und Gesundheitsminister Jens Spahn schürte jüngst die Hoffnung, in Deutschland könnte noch in diesem Jahr geimpft werden.
Die Wissenschaft führt eine so schnelle Zulassung in ein Dilemma: Denn was passiert mit den Probanden aus den groß angelegten Impfstudien, die nicht den Wirkstoff, sondern ein Placebo ohne jede Wirkung bekommen haben? Ist es ethisch vertretbar, ihnen einen wirksamen Impfstoff vorzuenthalten, um in Abgleich mit der Kontrollgruppe auch mögliche Langzeitfolgen zu untersuchen?
Immerhin: Laut den bisher vorliegenden Daten sind bei den Impfstudien nur leichte bis moderate Nebenwirkungen aufgetreten, die schnell wieder abgeklungen waren. So berichteten einige Probanden über Müdigkeit oder Kopfschmerzen nach der Impfung.
»Das Ausmaß der Pandemie, die wir derzeit erleben, ist einzigartig«, sagt Medizinethiker Georg Marckmann von der Ludwig-Maximilians-Universität in München dem SPIEGEL. Die ethischen Fragen bei Impfstudien ergeben sich allerdings aus dem Grundkonflikt der Forschung mit Menschen. Denn dass einige Probanden in groß angelegten Studien einen Wirkstoff bekommen und andere ein Placebo, gehört zum Standard in der medizinischen Forschung. So lässt sich die Wirksamkeit und Verträglichkeit zuverlässig nachweisen.
Im Fall eines Impfstoffs heißt das: Bleiben die Geimpften gesund, während Probanden aus der Placebo-Gruppe erkranken, wirkt das Mittel offenbar. Bekommen die Geimpften dagegen genauso häufig die Krankheit, die der Stoff eigentlich verhindern soll, fällt die Impfung durch. Unter welchen Bedingungen solche Studien mit Placebo-Gruppen stattfinden dürfen, regeln Ethikkommissionen.
Wer das echte Mittel bekommt und wer das Placebo, wissen die Probanden während der laufenden Studie nicht. Nur ein sogenanntes Data Safety Monitoring Board, kurz DSMB, erfährt, welche Probanden in welcher Gruppe sind. Diese Verblindung soll Manipulationen ausschließen.
Die Coronakrise stellt die Wissenschaft nun jedoch vor ganz neue Herausforderungen. Denn gleich mehrere Impfstoffkandidaten könnten bereits eine Zulassung bekommen, bevor Testreihen komplett abgeschlossen sind.
So empfiehlt die Europäische Arzneimittelagentur EMA, die über Zulassungen in der EU entscheidet, Studienteilnehmer sollten in den ihnen zugewiesenen Gruppen noch mindestens ein Jahr lang weiter beobachtet werden. Selbst, wenn die Impfung in dem Zeitraum schon zugelassen wird. »Diese längerfristigen Daten sind wichtig, um verspätete Nebenwirkungen zu dokumentieren und zu beurteilen, ob der Schutz gegen die von Sars-CoV-2 ausgelöste Krankheit mit der Zeit nachlässt«, heißt es in einer entsprechenden Empfehlung.
Wann Placebo-Gruppen ethisch vertretbar sind
Das könnte bedeuten, dass Teilnehmer der Placebo-Gruppe auch in den kommenden Monaten keine Impfung erhalten, selbst wenn dann eine verfügbar wäre. Ist das ethisch vertretbar? »Das hängt von verschiedenen Faktoren ab«, erklärt Marckmann. Wie hoch ist das Risiko für den Einzelnen, sich zu infizieren und schwer zu erkranken? Wäre der Impfstoff für die Betroffen tatsächlich schon verfügbar? Und rechtfertigt der zu erwartende zusätzliche Erkenntnisgewinn das Risiko für den Einzelnen?
»Bei einem Medikament, das schon in frühen Studienphasen eine hohe Wirksamkeit gegen eine tödliche Krankheit zeigt, wäre es ethisch problematischer, das Mittel den Patienten aus der Placebo-Gruppe vorzuenthalten«, so Marckmann. »Bei einer Impfung ist der Fall etwas anders. Denn sie verhindert eine Krankheit, die Probanden nur mit einer gewissen Wahrscheinlichkeit bekommen.« Allerdings müssten Probanden über etwaige Erfolge aufgeklärt werden.
»Wenn ein zugelassener, wirksamer und sicherer Impfstoff verfügbar ist, müssen die Studienteilnehmer darüber informiert werden«, so Marckmann. Insbesondere, wenn es sich um Risikogruppen handelt, die zuerst geimpft werden sollen.
Pfizer soll bereits nach Wegen suchen, solche Teilnehmer aus der Placebo-Gruppe in den Studienarm mit dem echten Impfstoff wechseln zu lassen, berichtet »Nature«. Das Fachblatt beruft sich auf einen entsprechenden Brief an die Probanden. Auch Hersteller AstraZeneca sieht in seinem Studienprotokoll vor, Teilnehmern aus der Placebo-Gruppe die echte Impfdosis anzubieten, sollte diese zugelassen werden – unter der Voraussetzung, es stehen ausreichend Dosen zur Verfügung.
Wie viele Teilnehmer im Zweifel wechseln wollen, muss sich zeigen. »Ein Grund, warum ich mitgemacht habe, war, dass es nach meinem Verständnis zum Standard einer verblendeten Studie gehört, die Verblindung aufzuheben, wenn sich die Impfung als sehr effektiv erweist, und allen Gruppen die Impfung anzubieten«, sagt eine Teilnehmerin aus der Studie mit dem Impfstoffkandidaten von Moderna zu »Nature«.
Wie sicher wären dann noch Aussagen über mögliche Nebenwirkungen? Angenommen, bei den Geimpften treten Beschwerden auf, könnte man in der Placebo-Gruppe überprüfen, ob dieselben Beschwerden dort vergleichbar häufig vorkommen. Falls ja, ist die Impfung sehr wahrscheinlich nicht die Ursache dafür.
Doch was passiert, wenn inzwischen alle aus der Studie geimpft wurden? »Eine Placebo-Gruppe brauchen wir vor allem, um zu bestimmen, ob der Impfstoff wirkt oder nicht«, so Marckmann. »Mögliche Nebenwirkungen lassen sich dann auch nach Abschluss der Studie beobachten. Beispielsweise mit einem Impfregister, in dem alle Immunisierungen und Nebenwirkungen erfasst werden.«
Laut »Nature« gibt es weitere Möglichkeiten, den Studienaufbau anzupassen, ohne das Versuchsergebnis zu gefährden. Probanden, die von der Placebo- in die Impf-Gruppe gewechselt sind, könnten beispielsweise separat ausgewertet werden. Ein vergleichbares Verfahren wurde bereits bei der Entwicklung des ersten Impfstoffs gegen Gürtelrose angewandt. Unternehmen könnten die Probanden zudem bitten, in der Studie zu bleiben, mit dem Versprechen, den Impfstoff sofort nach Auswertung der endgültigen Ergebnisse zu bekommen.
Nachdem ein Impfstoff gegen Covid-19 zugelassen ist, steht die Wissenschaft jedoch vor einem weiteren Dilemma. Dutzende weitere Impfstoffkandidaten sind noch im Rennen. Für entscheidende Studien der Phase III würden jedoch jeweils Zehntausende Teilnehmer benötigt. Ist es dann noch ethisch vertretbar, die Kontrollgruppe mit einem Placebo zu impfen?
»Eigentlich müsste man das Studiendesign ändern und den neuen Impfstoff gegen den bereits zugelassenen Impfstoff testen«, so Marckmann. »Wissenschaftlich gut begründete Placebo-Gruppen wären allenfalls dann ethisch vertretbar, wenn die damit verbundenen Risiken für die Probanden gering sind und der zugelassene Impfstoff für die Probanden noch nicht verfügbar wäre.«
Grundsätzlich müssen Studien mit Placebo-Gruppen nicht an mangelnder Teilnahme scheitern, glaubt Marckmann. »Immer wieder melden sich junge gesunde Menschen freiwillig für solche Studien, auch wenn sie selbst keinen Vorteil davon haben. Sie machen das aus Altruismus«, sagt der Medizinethiker.
Tatsächlich erklärte ein Proband aus der Studie mit dem Biontech-Impfstoff gegenüber »Nature«, er verstehe, wie wichtig die Placebo-Gruppe sei, und könnte sich vorstellen, weiter an der Studie teilzunehmen, selbst wenn er nicht den Impfstoff bekommen hat. Ein bisschen wie im Märchen.
spiegel
Tags: