Trotz vieler Studien ist das Wesen dieser Prionen bislang noch ungeklärt.
Europa im Alarmzustand
1995 wurde in Großbritannien bei zwei Jugendlichen eine sehr seltene Form der Bovinen spongiformen Enzephalopathie (BSE) bzw. Creutzfeldt-Jakob-Krankheit diagnostiziert. Im März 1996 wurden bereits zehn solcher Fälle festgestellt. Die Patienten litten unter Schmerzen, psychischen und neurodegenerativen Störungen, wonach sie nach kurzer Zeit starben.
Die Krankheit wurde auf die Verbreitung eines neuen Typs des Rinderwahns zurückgeführt – einer Infektionskrankheit, die Rindvieh, Schafe und Hirsche trifft. Seit langem kursieren Spekulationen, ob der Virus von Haustieren auf den Menschen übertragen werden kann. Laborexperimente zeigten, dass es ein Hindernis gibt, das das verhindert, doch wie der Ausbruch Mitte der 1990er Jahre zeigte, reichte er für den Schutz nicht aus.
Die Verbreitung der Krankheit sorgte für großes Aufsehen in der ganzen Welt. Es wurde von einer Krise im Gesundheitswesen der EU und vom Scheitern bei den vorhandenen Kenntnissen über die Ursachen des Rinderwahns gesprochen. Es begannen umfassende Studien, doch nach 30 Jahren können die Wissenschaftler immer noch nicht eindeutig die Hauptfrage beantworten: Wie hoch ist das Risiko, sich beim Konsum von gezüchtetem Tierfleisch mit Prionen-Krankheiten zu infizieren?
Schreckliche Prionen
Eiweiß ist das wichtigste Baumaterial des lebendigen Körpers. Es wird in Zellen gemäß den in der DNA festgelegten Informationen synthetisiert. Um ihre Funktionen zu erfüllen, drehen sich die Eiweißmoleküle auf bestimmte Weise. Störungen bei diesen Prozessen vergiften den Körper und können Erkrankungen auslösen. Die Klasse dieser pathogenen Proteine, für deren Synthese die Fehler im Gen PRNP verantwortlich sind, heißen Prionen.
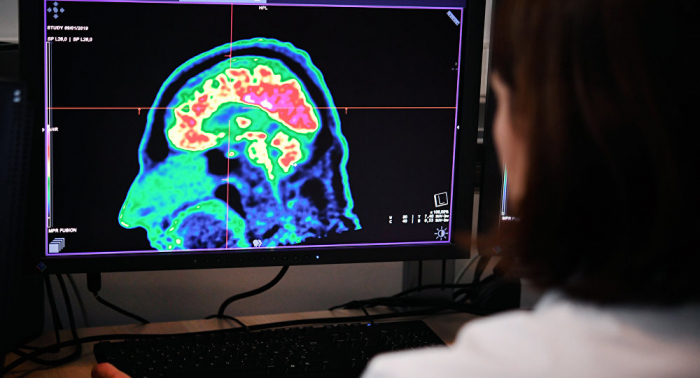
Laut einer verbreiteten Hypothese sind es gerade die Prionen, die verschiedene Typen der Bovinen spongiformen Enzephalopathie bei Tieren und Menschen auslösen. Sie können gesunde Eiweiße infizieren und sich vermehren, wobei so genannte „Samen“ der polymeren Ketten genutzt werden. Wegen der fehlerhaften Struktur kleben sie zusammen und bilden Plaquen im Gehirn, wobei die Arbeit der Neuronen gestört wird. Im Ergebnis funktioniert das Gehirn nicht mehr normal und stirbt. Prionen-Krankheiten kommen bei Menschen sehr selten vor. Es sind 231 Fälle bekannt, 178 davon in Großbritannien. Nach dem Höhepunkt in den Jahren 2001 und 2002 sinkt ihre Zahl.
Bei den Kranken wurde die Mutation im 129. Kodon des 20. Chromosoms entdeckt, was auf eine genetische Neigung zu dieser Krankheit hinweist. Nach vorhandenen Angaben hat jeder 2000. Bewohner Großbritanniens diese Mutation. Wissenschaftlern zufolge könnte bei diesen Menschen diese Krankheit sieben bzw. zehn Jahre nach der Inkubationszeit ausbrechen. Träger dieser Mutation müssen nicht unbedingt krank werden, können aber andere Menschen via Spende von Blut und Organen, z.B. Netzhaut infizieren. Dieser Weg der Verbreitung der Krankheit wird jetzt aktiv erforscht.
Alterung und falsches Eiweiß
In den vergangenen Jahren wurden neue Typen von Prionen-Krankheiten bei Tieren und Menschen entdeckt. So wurden sie bei Kamelen und Katzen festgestellt. Es wurde nachgewiesen, dass sich Meerkatzen damit anstecken können.
1992 wurde die Prionen-Natur einer sehr seltenen Erbkrankheit festgestellt – die so genannte Tödliche familiäre Schlaflosigkeit (FFI). Die Krankheit zeigt sich bei Erwachsenen, der Mensch kann nicht schlafen, bekommt Halluzinationen und stirbt anschließend. Der Grund ist ebenfalls eine Mutation am Gen PRNP, die normales Eiweiß in Prion verwandelt.
Forscher stellten fest, dass das Eiweiß, das für das Gen PRNO zuständig ist, mehrere Formen hat, von denen eine toxisch ist. Die Tests an Mäusen ließen feststellen, dass normale Prionen im Gehirn eines Embryos auftauchen und es während seiner Entwicklung begleiten. Bei erwachsenen Einzeltieren sind sie in Herz- und Skelettmuskeln, Immunzellen zu finden.
Gute Prionen spielen eine Rolle bei der Übergabe der Signale via Zellmembranen, bei Metabolismus von Kupferionen, treten auch als Neuroprotektoren auf.
Eiweiß mit einer falschen Struktur (Beta-Amyloide) begleiten altersbedingte unheilbare Störungen wie Alzheimer, Parkinson, Huntington und Demenz. In der letzten Zeit wird die Hypothese analysiert, dass Beta-Amyloide sich auch im Körper ansammeln und sich wie pathogene Prionen verbreiten. Trotz aktiver Studien ist bis heute unklar, warum im Körper Prionen und Beta-Amyloide entstehen und ob sie Funktionsstörungen im Gehirn verursachen bzw. umgekehrt. Die damit verbundenen Erkrankungen sind nach wie vor unheilbar.
sputniknews
Tags: